C’est l’histoire d’un homme d’une cinquantaine d’années qui présente une complication si rare qu’elle peut surprendre même des cliniciens chevronnés : de l’urine se trouve dans la cavité pleurale. En d’autres termes, de l’urine est présente au niveau du thorax, plus précisément dans l’espace compris entre les deux feuillets de la plèvre, la membrane qui enveloppe les poumons. Cette cause rare d’épanchement pleural (ou pleurésie) porte un nom évocateur : urinothorax.
Ce cas clinique, rapporté en juin 2025 par des médecins britanniques de l’hôpital Freeman de Newcastle upon Tyne dans la revue en ligne BMJ Case Reports, illustre que l’urine peut migrer vers un espace où on ne l’attend absolument pas, provoquant une complication rare, mais parfaitement compréhensible sur le plan physiopathologique. Nous y reviendrons.
Ce patient quinquagénaire, diabétique, vient de subir une néphrolithotomie percutanée, un geste qui consiste à pratiquer une petite incision dans le dos, puis à introduire directement dans le rein un tube, appelé néphroscope, permettant la vision directe des cavités rénales. On insère ensuite un instrument à travers le néphroscope pour fragmenter, par laser ou ultrasons, le calcul en plus petits morceaux et extraire les fragments.
Le patient présente un calcul rénal coralliforme. Volumineux et ramifié, celui-ci épouse partiellement la forme du bassinet rénal et des calices, les cavités internes du rein où s’accumule l’urine. Son aspect évoque les ramifications d’une branche de corail, d’où son nom. Ce patient a également bénéficié de la pose d’un stent urétéral, un petit tube souple qui, en contournant l’obstacle que représente le calcul, assure l’écoulement de l’urine depuis le bassinet, cavité située au centre du rein qui collecte l’urine, jusqu’à la vessie.
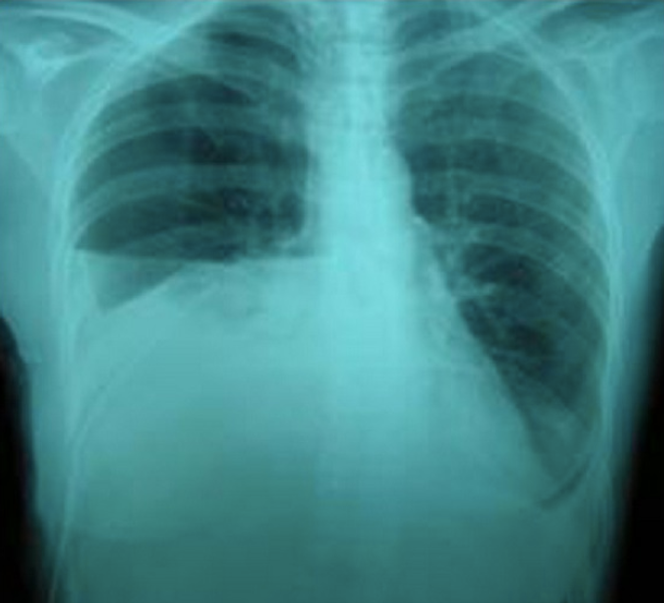
L’intervention se déroule sans incident, mais voilà que le surlendemain, cet homme présente une gêne respiratoire croissante. Une échographie thoracique et un scanner révèlent alors un épanchement pleural modéré, une petite brèche dans le diaphragme et une lésion dans la zone du rein correspondant au point de ponction de la néphrolithotomie percutanée.
Au scanner, on observe une fuite du produit de contraste du rein vers l’espace pleural, ce qui confirme que de l’urine s’échappe des voies urinaires vers la plèvre.
Les lésions pleurales sont une complication reconnue de la néphrolithotomie percutanée, survenant dans environ 5 % des cas lors de ponctions sous la 12e côte et jusqu’à 10 % lors de ponctions au-dessus de la 12e côte.
L’échographie thoracique révèle un épanchement pleural gauche modéré. En raison de la gêne respiratoire et du besoin en oxygène, un drain thoracique est posé. L’analyse du liquide pleural révèle un taux de lactate déshydrogénase (LDH) à 310 UI/L et des protéines à 7 g/L – des valeurs compatibles avec un transsudat, c’est-à-dire un épanchement pauvre en protéines, résultant d’un transfert passif de liquide dans la cavité pleurale.
Mais le détail décisif réside dans le taux de créatinine. Son dosage sanguin est essentiel pour évaluer la fonction rénale. Chez ce patient, le rapport créatinine pleurale/créatinine plasmatique est supérieur à 1, ce qui est en faveur du diagnostic d’urinothorax. Le fait que le liquide contenu dans la plèvre contienne plus de créatinine que le sang indique qu’il s’agit d’urine et non d’une simple accumulation de liquide secondaire à une insuffisance cardiaque ou à une infection pulmonaire.
Un phénomène rare, décrit récemment
En 1968, Joseph Corriere et ses collègues de Philadelphie démontrent expérimentalement chez le chien qu’une distension des cavités rénales (hydronéphrose) due à une accumulation d’urine en cas d’obstruction urétérale peut entraîner un épanchement pleural, le plus souvent du même côté que la lésion.
En 1971, Gerald Friedland (université de Stanford, Californie) rapporte un cas humain. Celui-ci concerne un nouveau-né de sexe masculin de trois semaines atteint de valves urétrales postérieures, anomalie congénitale caractérisée par la persistance anormale de replis muqueux dans la lumière de l’urètre entraînant une obstruction en amont et un blocage de la vidange normale de la vessie. Chez cet enfant, cela a provoqué une dilatation sévère de l’appareil urinaire et la présence d’urine dans la plèvre. Friedland propose alors le terme d’urinothorax pour désigner ce type d’épanchement pleural.
Une revue de la littérature médicale couvrant la période 1960 – 2016 a identifié 88 patients atteints d’urinothorax dans 78 publications, soit une soixantaine d’années de cas, ce qui en dit long sur la rareté de cette entité. On est donc loin d’un diagnostic courant, même pour un pneumologue ou un urologue. Depuis 2016, quelques cas supplémentaires ont été publiés, mais on reste probablement sous la barre de la centaine de patients décrits dans la littérature mondiale.
L’urinothorax peut survenir à tout âge, avec une légère prédominance masculine. Il se développe habituellement du même côté que la lésion rénale ou l’obstruction urinaire, bien que des cas bilatéraux ou controlatéraux aient été décrits. Il se manifeste généralement dans les huit heures à deux mois suivant l’événement déclencheur, avec un délai moyen de deux jours.
Les causes sont multiples. Elles incluent une obstruction urinaire, notamment du fait d’un cancer de la prostate ou de la vessie, de calculs rénaux, de valves urétrales ou d’un un traumatisme fermé du rein.
L’urinothorax peut aussi se développer dans les suites d’une intervention sur les voies urinaires ou sur le rein : lithotripsie (procédure visant à fragmenter ou pulvériser des calculs rénaux), néphrostomie (mise en communication des cavités excrétrices intra-rénales avec l’extérieur, au niveau de la peau, au moyen d’une sonde ou d’un cathéter traversant le tissu rénal et sortant dans la région lombaire), néphrolithotomie percutanée, biopsie rénale, transplantation rénale.
Dans certains cas, le scanner met en évidence la présence de calculs sur le trajet du néphroscope ou dans la cavité pleurale, traduisant l’existence d’un trajet anormal (fistule) entre le rein et la plèvre.
Fuite d’urine secondaire à une obstruction ou à une lésion des voies urinaires
Le mécanisme de transfert d’urine dans la cavité pleurale pourrait s’expliquer de deux façons distinctes.
Première hypothèse : la survenue de l’urinothorax pourrait être due à la présence de minuscules brèches, ou de petits pores, dans le diaphragme. Un urinome, le plus souvent rétropéritonéal, parfois périrénal – épanchement urinaire profond dans l’abdomen ou à proximité du rein – s’infiltrerait ainsi vers la plèvre, franchissant la cloison qui sépare le thorax de la cavité abdominale.
Seconde hypothèse : en cas d’obstruction urinaire, l’urine pourrait migrer vers la cavité pleurale – où règne une pression négative – via le drainage lymphatique. Elle transiterait ainsi par les vaisseaux lymphatiques lorsque la pression abdominale augmente, par exemple lors d’un urinome rétropéritonéal important. Ces mécanismes expliquent pourquoi l’urinothorax est habituellement homolatéral.
Les signes et symptômes cliniques les plus fréquents sont une respiration difficile et pénible (dyspnée), des douleurs thoraciques, des douleurs abdominales et la baisse de la diurèse, c’est-à-dire une diminution du volume d’urine produit par les reins, accompagnées plus rarement de fièvre ou d’une collection liquidienne située dans la cavité péritonéale (ascite). Les symptômes respiratoires ne sont pas présents chez tous les patients, de sorte que leur absence ne doit pas exclure une évaluation complémentaire.
L’épanchement pleural est le plus souvent un transsudat, avec un pH acide inférieur à 7,30 et une concentration en lactate déshydrogénase (LDH) souvent modérément élevée. Cette enzyme est un marqueur non spécifique de dommage cellulaire en n’importe quel point de l’appareil génito-urinaire.
Il existe cependant des exceptions concernant le pH. En cas d’urinothorax et d’infection urinaire concomitante par des bactéries « uréase positives » telles que Proteus ou Klebsiella, qui décomposent l’urée présente dans l’urine en ammoniac (NH₃) et dioxyde de carbone (CO₂), l’urine peut devenir plus alcaline. De même, le taux de LDH est dit « discordant » dans de très nombreux cas, autrement dit il est souvent élevé alors que le reste du profil biologique fait plutôt penser à un simple transsudat : cela peut faire croire à tort à un épanchement inflammatoire important, alors que le taux de LDH augmente ici pour d’autres raisons et ne suffit pas, à lui seul, à orienter le diagnostic.
Dans une revue de la littérature analysant des cas publiés entre 1960 et 2016, 56 % des urinothorax étaient classés comme des transsudats et 44 % comme des exsudats selon les critères biochimiques usuels, certains cas ne pouvant être classés faute de données complètes. Parmi les exsudats, la majorité étaient justement des exsudats « LDH-discordants ».
L’odeur caractéristique et la couleur du liquide pleural (jaune citrin) sont évocatrices. L’analyse des cellules présentes dans l’épanchement pleural peut révéler des cellules épithéliales qui tapissent la paroi de l’appareil urinaire. Celles-sont identifiées grâce à des marqueurs immunohistochimiques. Ce n’est pas un examen courant, mais un outil supplémentaire dans les situations diagnostiques complexes.
Dosage de la créatinine pleurale et plasmatique
Un rapport créatinine pleurale/créatinine plasmatique supérieur à 1 reste le marqueur biochimique le plus spécifique pour confirmer l’urinothorax, même s’il n’est pas absolument exclusif de cette pathologie. Un rapport supérieur à 1,7 a une grande valeur diagnostique dans un contexte clinique évocateur. La créatinine est une petite molécule filtrée par le rein et excrétée dans l’urine. Sa concentration y est normalement beaucoup plus élevée que dans le sang. Dans le cas rapporté par les pneumologues de Newcastle upon Tyne, le rapport créatinine pleurale/créatinine plasmatique était supérieur à 1, confirmant l’urinothorax.
L’imagerie abdominale, scanner ou échographie, permet d’identifier l’obstruction urinaire ou le trajet de l’urine du rein vers la cavité pleurale. Lorsque l’analyse biochimique du liquide pleural est atypique, une scintigraphie rénale au technétium 99m peut confirmer le trajet de l’urine. Ce traceur radiomarqué, filtré par le rein, apparaît progressivement dans la cavité pleurale du même côté, dessinant le trajet de l’urine depuis le rein jusqu’à la plèvre.
Le traitement vise à lever l’obstruction urinaire, par exemple en posant une sonde double-J. Ce tuyau souple, de 2 à 3 mm de diamètre, est placé dans l’uretère, le canal reliant chaque rein à la vessie. Les deux extrémités forment une boucle, d’où le nom de « double J ». Ce dispositif permet de drainer, de chaque côté, l’urine bloquée du rein vers la vessie et de réduire rapidement l’épanchement pleural.
La résolution concomitante quasi-complète de l’urinothorax après correction de l’obstruction illustre l’importance d’une prise en charge multidisciplinaire, associant urologue et pneumologue.
Un drainage de la plèvre est réalisé dans un but diagnostique (pour analyser le liquide pleural) et thérapeutique (pour soulager de la gêne respiratoire). La chirurgie thoracique n’est généralement pas nécessaire, la brèche diaphragmatique cicatrisant spontanément. Il n’est pas recommandé de réaliser une symphyse pleurale (ou pleurodèse), intervention consistant à accoler les deux feuillets de plèvres et donc à effacer la cavité pleurale.
Dans de très rares cas, l’urinothorax se manifeste sous la forme d’une pleurésie purulente lorsque le rein est infecté. Dans cette situation, une antibiothérapie adaptée doit être associée traitement de l’uropathie obstructive et au drainage pleural.
Un diagnostic à évoquer dans un contexte de pathologie urinaire ou de procédure urologique récente
Concernant le patient dont le cas est relaté dans BMJ Case Reports, les scanners de suivi réalisés deux et trois semaines plus tard ont montré la résolution de l’urinome abdominal, l’absence de nouvel épanchement pleural et une amélioration globale de l’état clinique.
Ce cas clinique souligne l’importance d’évoquer un urinothorax devant tout épanchement pleural homolatéral survenant après une procédure urologique récente ou dans un contexte d’obstruction des voies urinaires. Il illustre parfaitement comment une pathologie respiratoire peut être le révélateur d’un problème urologique, ce qui, a priori, n’a rien d’évident.
Pour en savoir plus :
Tuen TQ, Fitzpatrick J, Anderson K, Stanton AE. Urinothorax – watery wee where it should not be. BMJ Case Rep. 2025 Jun 19 ; 18 (6) : e265740. doi : 10.1136/bcr-2025-265740
Shayani KE, Schwartz J, Oslance N et al. Urinothorax and pleural fluid creatinine : a retrospective analysis of pleural fluid studies at a tertiary care center and a review of the literature. J Thorac Dis. 2025 Nov 30 ; 17 (11) : 9357-9363. doi : 10.21037/jtd-2025-879
Rashid Ali MRS, Meng TT. Urinothorax With Fungal Empyema-A Rare and Unique Combination. Respirol Case Rep. 2025 Apr 15 ; 13 (4) : e70182. doi : 10.1002/rcr2.70182
Pisciotti A, Hsu D, Afridi MO, Underberg-Davis S. Urinothorax : A rare complication of vertebral body tethering. Radiol Case Rep. 2025 Mar 8 ; 20 (5) : 2549-2552. doi : 10.1016/j.radcr.2025.02.021
Chen R, Porto JG, Blachman-Braun R, et al. Case of the month from the Desai Sethi Urology Institute, Florida, USA : bladder outlet obstruction-induced urinothorax after percutaneous nephrolithotomy. BJU Int. 2025 Feb ; 135 (2) : 237-242. doi : 10.1111/bju.16393
Cocelli C, Ren S. Diagnosis of Urinothorax : A rare Complication of Percutaneous nephrolithotomy and literature review. Hum Pathol Rep. 2024 Sep ; 37 : 300760. doi : 10.1016/j.hpr.2024.300760
Glozman T, Kooner S, Kostowniak C, et al. A rare case of infected urinothorax. Respir Med Case Rep. 2024 Jan 24 ; 47 : 101989. doi : 10.1016/j.rmcr.2024.101989
Nedjim SA, Abdi EM, Hagguir H, et al. Urinothorax, another complication of bladder tumor : case report. Afr J Urol. 2021 ; 27 : 125. doi : 10.1186/s12301-021-00228-9
Vergne F, Le Mao R, Simonin L, et al. Une pleurésie très inhabituelle. Rev Mal Respir. 2018 May ; 35 (5) : 567-570. doi : 10.1016/j.rmr.2017.10.665
Austin A, Jogani SN, Brasher PB, et al. The Urinothorax : A Comprehensive Review With Case Series. Am J Med Sci. 2017 Jul ; 354 (1) : 44-53. doi : 10.1016/j.amjms.2017.03.034
Toubes ME, Lama A, Ferreiro L, et al. Urinothorax : a systematic review. J Thorac Dis. 2017 May ; 9 (5) : 1209-1218. doi : 10.21037/jtd.2017.04.22
Rakotoarivelo HN, Rondeau-Lutz M, Groza M. L’urinothorax, une cause inhabituelle d’épanchement pleural. Rev Pneumol Clin. 2015 Dec ; 71 (6) : 372-374. doi : 10.1016/j.pneumo.2015.01.002
Friedland GW, Axman MM, Love T. Neonatal » ; urinothorax » ; associated with posterior urethral valves. Br J Radiol. 1971 Jun ; 44 (522) : 471-4. doi : 10.1259/0007-1285-44-522-471
Corriere JN Jr, Miller WT, Murphy JJ. Hydronephrosis as a cause of pleural effusion. Radiology. 1968 Jan ; 90 (1) : 79-84. doi : 10.1148/90.1.79

